
GénoPsy recrute
Le Réseau GénoPsy : Troubles du comportement d’origine génétique, est un réseau national composé de 5 Centres de Référence Maladies Rares (CRMR) et de 6 Centres de Compétence Maladies Rares (CCMR). Le CRMR GénoPsy Lyon situé à l’hôpital du Vinatier en est le centre coordonnateur.
Labellisé en 2023 dans le cadre du nouveau Plan National maladies rares (PNMR3), il est porté par la filière de santé AnDDi-Rares.
Le réseau GénoPsy a pour objectif principal d’initier et de faciliter la collaboration entre les différents acteurs régionaux, nationaux et internationaux impliqués dans la recherche, le diagnostic, la formation et le soutien des personnes atteintes de maladies rares d’origine génétique avec des manifestations psychiatriques ainsi que de leur famille.
Description du poste
Placé·e sous la direction de la coordinatrice du réseau, la Professeure Caroline Demily, et en collaboration avec la cheffe de projet partenariats, le/la chef·fe de projet a pour mission de déployer la communication et d’animer le réseau.
Missions
Communication du Réseau GénoPsy
- Conception graphique
- Réalisation de vidéos
- Animation des réseaux sociaux
- Envoi d’une newsletter
- Création d’un site internet et de divers supports de communication
- Aide à la diffusion et à la reconnaissance de l’innovation clinique et scientifique
Animation du Réseau GénoPsy
- Organisation d’évènements scientifiques et grand public
- Faire le lien avec tous les CRMR et CCMR du réseau
- Mise en relation des acteurs du réseau pour construire des projets
- Aide à l’élaboration des projets de recherche
- Concourir à la bonne implantation des activités du réseau à l’échelon national
- Développer des synergies avec le Centre d’Excellence iMIND
- Veille scientifique
Formation
- Aide à l’élaboration et la promotion des formations du réseau
Gestion administrative
- Suivi de la base de données BAMARA
- Recueil des variables quantitatives de l’activité du CRMR Lyon
- Réalisation du bilan d’activité annuel, gestion des COPIL et rédaction des comptes-rendus
- Gestion des données / informations / indices qualité (recueil, saisie, analyse, diffusion, classement, suivi)
Profil recherché
- Avoir le sens de l’organisation et des priorités, pouvoir développer une vision intégrative
- Être dynamique et responsable de sa pratique
- Être disponible et flexible en termes d’horaires
- Être capable d’autonomie et de prise d’initiatives tout en respectant les règles de fonctionnement institutionnel
- Accompagner les porteurs de projet dans les démarches de recherche clinique (CCP, etc.)
- Pouvoir accompagner les autres professionnels dans les partenariats à tisser
- Capacités d’intégration au sein d’une équipe pluriprofessionnelle.
Formation souhaitée
- Bac + 5 – Équivalent chefferie de projet ou scientifique
Expérience professionnelle
- Expérience dans le champ de la gestion de projet, valorisation, communication. Une connaissance de la psychiatrie, des maladies rares et/ou des troubles du neurodéveloppement serait appréciée
Connaissances spécifiques attendues
- Maîtrise de Microsoft Office, la suite Adobe, CANVA et WordPress
- Aisance rédactionnelle ainsi qu’à l’oral
- Pouvoir se déplacer en dehors de Lyon (Permis B)
Informations sur le poste
- Type de contrat : CDD de 6 mois renouvelable avec possibilité de pérennisation
- Cycle hebdomadaire du lundi au vendredi
- Temps de travail : 100%
- Amplitudes horaires : 8h30 – 19h00
(en fonction des activités, disponibilité en dehors de ces créneaux possible) - Télétravail possible
- Lieu d’exercice : pôle HU-ADIS sur le site du Campus Hospitalier le Vinatier
- Salaire : selon profil et expérience
- Prise de poste : souhaitée début octobre 2024
Vous souhaitez candidater
- Pour postuler, envoyez un CV et une lettre de motivation avant le 31 août 2024 aux adresses suivantes: caroline.demily@ch-le-vinatier.fr – jennifer.beneyton@ch-le-vinatier.fr
- Préciser dans l’objet du mail : « POSTE Chef de projet – Réseau GénoPsy »

De la recherche fondamentale au patient, il n’y a parfois qu’un pas.
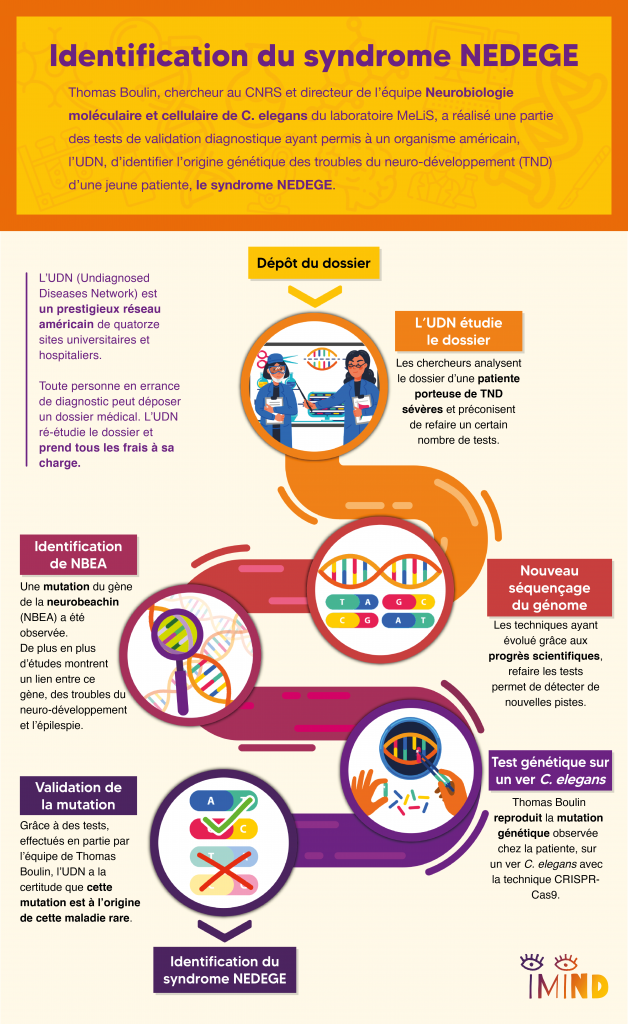
Thomas Boulin, chercheur au CNRS et directeur de l’équipe « Neurobiologie moléculaire et cellulaire de C. elegans » du laboratoire MeLiS, a réalisé une partie des tests de validation diagnostique qui a permis à un organisme américain, l’UDN, d’identifier l’origine génétique des troubles du neuro-développement (TND) d’une jeune patiente, le syndrome NEDEGE qui résulte d’une mutation du gène NBEA. Lui qui d’habitude se passionne pour des questions de recherche fondamentale, a éprouvé un regain d’enthousiasme à pouvoir appliquer sa recherche pour confirmer le diagnostic d’une jeune patiente américaine.

« La recherche, ce n’est pas un chercheur qui se lève le matin en décidant d’étudier une pathologie pour savoir comment elle fonctionne. Ça ne se passe pas comme ça, sinon, on n’aurait plus de cancer ».
C’est avec ces mots que Thomas Boulin a commencé son récit. En effet, la recherche scientifique reste un mystère pour beaucoup. On distingue la recherche fondamentale, qui vise à comprendre les phénomènes biologiques et dont le but est le progrès de la connaissance, à laquelle on oppose souvent, de façon erronée, la recherche appliquée dont le but est de répondre à une question précise, par exemple clinique. Alors que le financement de la recherche se fait aujourd’hui essentiellement par appels d’offres ciblés, la recherche fondamentale est davantage critiquée sur son utilité, en comparaison à la recherche appliquée, plus concrète à première vue. Or, sans recherche fondamentale, pas de recherche appliquée car celle-ci s’appuie sur le socle de connaissance issu de la recherche fondamentale. L’équipe de Thomas Boulin du laboratoire MeLiS étudie le fonctionnement des canaux potassiques qui régulent l’activité électriques des neurones. En d’autres termes, il cherche à comprendre les conditions nécessaires, au niveau moléculaire, pour que l’information circule correctement dans nos réseaux neuronaux. Ses travaux se situent donc dans le champ de la recherche fondamentale. C’est pourtant grâce à ces travaux qu’il a pu développer un nouvel outil diagnostic pour le syndrome NEDEGE.
Le parcours diagnostic dans les maladies rares
Beaucoup de maladies rares ont une origine génétique. Le parcours patient classique consiste à faire des examens génétiques pour identifier des gènes-candidats, c’est-à-dire des gènes comportant une mutation qui pourrait être à l’origine de la maladie rare. En plus du génome du patient, on séquence donc le génome des parents car ces mutations apparaissent fréquemment après la fertilisation de l’ovocyte par un accident génétique lors de la reproduction de l’ADN. On dit qu’il s’agit de « mutations de novo ». Aucun des deux parents n’ayant la mutation, la comparaison du génome des parents et de l’enfant permet d’identifier cette liste de gènes-candidats. Souvent, le parcours médical s’arrête là car les médecins n’ont pas forcément les savoirs, ni les outils technologiques pour aller plus loin. C’est là qu’entre en scène Hugo Bellen, un généticien de la mouche Drosophile et son réseau américain, UDN, Undiagnosed Diseases Network, dont l’originalité est de mettre des plateformes technologiques de pointe au service du diagnostic génétique et de démontrer qu’une mutation est bien à l’origine de la maladie du patient.
Qu’est-ce que l’UDN?
 L’UDN, pour Undiagnosed Diseases Network, est un réseau américain de quatorze sites universitaires et hospitaliers les plus prestigieux du pays, financé par le NIH. Un patient, ou sa famille, en errance diagnostique peut déposer auprès de cet organisme un dossier composé de tous ses antécédents et tests médicaux. Pour les patients pris en charge, l’UDN étudie tous les éléments du dossier et va actualiser certains tests ou faire des tests complémentaires, à la lumière des avancées technologiques et scientifiques les plus récentes. C’est entièrement pris en charge par le réseau, ce qui n’est pas négligeable lorsqu’on connaît le coût des frais médicaux aux États-Unis.
L’UDN, pour Undiagnosed Diseases Network, est un réseau américain de quatorze sites universitaires et hospitaliers les plus prestigieux du pays, financé par le NIH. Un patient, ou sa famille, en errance diagnostique peut déposer auprès de cet organisme un dossier composé de tous ses antécédents et tests médicaux. Pour les patients pris en charge, l’UDN étudie tous les éléments du dossier et va actualiser certains tests ou faire des tests complémentaires, à la lumière des avancées technologiques et scientifiques les plus récentes. C’est entièrement pris en charge par le réseau, ce qui n’est pas négligeable lorsqu’on connaît le coût des frais médicaux aux États-Unis.
Dossier UDN N°068
Bien que doté de moyens très importants, ce réseau s’appuie aussi sur l’expertise de collaborateurs internationaux et lance régulièrement des appels à la communauté scientifique. C’est ainsi qu’un jour apparaît sur ce portail le cas d’une jeune fille américaine porteuse d’un trouble du neuro-développement sévère avec un trouble du développement intellectuel et des crises d’épilepsie fréquentes pour laquelle l’UDN a identifié le gène Neurobeachin (NBEA) comme gène-candidat principal. En effet, une étude de 2019 très récente avait montré un lien entre les troubles du neuro-développement, l’épilepsie et ce gène. Quand Thomas voit cet appel, ça fait tilt !
Il se trouve que Sonia El Mouridi, doctorante dans l’équipe, avait découvert un rôle nouveau de la Neurobeachin dans les processus biologiques qui intéressent l’équipe. N’étant pas le cœur de son projet de doctorat, cette observation était simplement présentée dans une annexe de sa thèse sans avoir été formellement publiée. Qui aurait pu prédire que, quelques années plus tard, forte de ces résultats et de son expertise sur le ver C. elegans, l’équipe de Thomas allait pouvoir réaliser pour l’UDN une partie des tests de validation fonctionnelle démontrant que cette mutation inconnue jusque-là était bien à l’origine des troubles de la patiente et aider ainsi à confirmer le diagnostic génétique de la maladie rare de cette jeune fille.
Comment l’équipe s’y est-elle prise ?
Un modèle animal sur mesure
Pour démontrer l’effet délétère d’une mutation identifiée chez un patient, il est très souvent nécessaire de passer par des modèles animaux. La souris serait tout à fait pertinente mais cela reste extrêmement cher et long et surtout, impossible à réaliser à grande échelle. L’approche préconisée par l’UDN et Thomas Boulin s’oriente donc vers des modèles animaux plus simples, moins coûteux et où le temps de génération est plus rapide. Ainsi la drosophile, le poisson zèbre, mais aussi le ver C. elegans sont des modèles de choix. On est en droit de se demander en quoi la drosophile ou le ver C. elegans sont des modèles pertinents pour étudier l’humain étant donné que nous n’avons pas grand-chose en commun à première vue. Il s’avère en réalité, que notre patrimoine génétique n’est pas si différent. Les gènes affectés dans les maladies rares sont souvent des gènes très importants, maintenus au cours de l’évolution, et que l’on retrouve chez l’humain, mais aussi chez la drosophile ou le ver C. elegans. C’est ce qu’on appelle la conservation évolutive.
Qu’est-ce que C. elegans ?
Le nématode C. elegans est un ver d’un millimètre de long, à peine visible à l’œil nu. Il est l’un des modèles animaux utilisés en biologie depuis 50 ans pour disséquer les processus biologiques fondamentaux, comme par exemple la mort cellulaire programmée qui est impliquée dans le cancer. Cet « organisme modèle pionnier » est très prisé pour les études génétiques du fait de sa robustesse, de son temps de génération extrêmement rapide (3 jours), des nombreux outils génétiques disponibles et de son coût très limité.
La révolution CRISPR-Cas9
Récapitulons : nous avons une patiente, un gène candidat, NBEA, et un modèle animal, le ver C. elegans, spécialité de l’équipe de Thomas. La première étape a donc consisté à reproduire la mutation identifiée chez la patiente dans le génome de C. elegans afin de créer un « modèle sur mesure ». Grâce à la technologie des « ciseaux moléculaires » CRISPR-Cas9, on peut aujourd’hui d’introduire une cassure dans un gène cible afin de forcer la cellule à la réparer avec une séquence génétique artificielle, contenant la mutation. Avant de mettre au point cette technologie, on avait tendance à surexprimer les protéines mutées, ce qui a souvent des effets délétères et peut entraîner des artefacts. L’approche CRISPR-Cas9 permet maintenant de faire des modifications génétiques de façon très fine, sans modifier ce qu’il y a autour. On peut ainsi étudier l’impact d’une mutation dans un modèle animal de la façon la plus fidèle possible.
La validation de mutation
La Neurobeachin est une protéine immense composée de 2500 lettres, ou acides aminés. Or, la mutation de la patiente n’affecte qu’un seul de ces acides aminés, et ce, en opérant un simple remplacement par un autre acide aminé. Or les dysfonctionnements produits par ce type de substitutions sont presque impossibles à prédire théoriquement. Grâce aux animaux génétiquement modifiés, Thomas et son équipe ont donc procédé à différents tests fonctionnels pour vérifier l’impact de la mutation sur le fonctionnement de la Neurobeachin. Grâce à ces tests, l’UDN a été en mesure de conclure avec certitude que cette mutation sur le gène NBEA de la patiente était bien à l’origine de sa maladie rare.
De l’importance d’identifier ces syndromes
Valider l’impact d’une mutation et mettre un nom sur un syndrome permet d’apporter la certitude au patient, à ses proches et à l’équipe médicale que la pathologie est bien liée à la mutation d’un gène. L’errance diagnostique prend fin, ce qui représente souvent un grand soulagement psychologique pour la famille. Une fois que le diagnostic a été posé, les personnes concernées par ce syndrome peuvent se rencontrer : d’une part pour échanger sur leur quotidien, se conseiller, s’épauler et d’autre part pour avoir une idée de l’évolution de la maladie. Ils peuvent aussi se regrouper en associations dans le but de communiquer et de lever des fonds pour encourager les travaux de recherche dans ce domaine. Il y a sans doute d’autres patients dans le monde avec une mutation de la Neurobeachin, dont on pense simplement qu’ils sont épileptiques ou qu’ils ont un trouble du neuro-développement. Le véritable enjeu aujourd’hui est d’associer les deux, troubles du neuro-développement et Neurobeachin, pour que les généticiens testent aussi ce nouveau gène si les symptômes sont concordants.
Que sait-on sur la Neurobeachin (NBEA)?
Il existe encore peu d’informations sur cette protéine. Elle est essentiellement exprimée dans le cerveau et joue vraisemblablement un rôle très important dans les systèmes de contrôle de l’activité cérébrale. NBEA a été identifié comme gène candidat pour des maladies avec TND en 2003. Une simple mutation de ce gène peut entraîner des conséquences très sévères du point de vue neuro-développemental. Certains gènes supportent facilement des mutations dans leur séquence. D’ailleurs, si l’on compare le génome de deux personnes lambda, on va s’apercevoir qu’il y a beaucoup de différences entre elles, ce qui est tout à fait normal. Mais certains de nos gènes supportent moins bien les mutations. NBEA est un exemple de ces gènes extrêmement contraints qui ne tolèrent presque aucune mutation.
Depuis, l’équipe de Thomas a décroché un financement sur 4 ans de l’Agence Nationale de Recherche pour mieux comprendre les bases moléculaires et cellulaires du fonctionnement de la NBEA. Il collabore aussi avec Tristan Sands de l’Université de Columbia sur la validation diagnostique chez de nouveaux patients.
« Le travail de Sonia n’avait pas du tout pour finalité de résoudre l'errance diagnostique de cette petite fille. Or c’est ce qui s’est passé, l’histoire est belle et donne du sens à notre recherche. Et cela montre à quel point la recherche fondamentale est nécessaire et importante, et qu’il ne faut pas être trop contraint dans nos idées. », souligne Thomas.
En résumé
Formation de sensibilisation aux maladies rares
Evolu'Psy, Génopsy

Sous la responsabilité de Marin Herreman, Clémentine Aubry, Caroline Demily, Catherine Mouillac-Vuillet, marie-Noëlle Babinet
Professionnel de proximité, il vous arrive d’accompagner au quotidien une ou des personnes (enfant et/ou adulte) qui présentent une maladie rare entrainant des troubles du neurodéveloppement (exemple : syndrome de Smith-Magenis, Prader-Willi, délétion22q11, Williams-Beuren, X-Fragile, Angelman, autres …). Face à ces diagnostics et à leurs manifestations psychiatriques complexes qui peuvent légitimement interroger les pratiques professionnelles, l’équipe du Centre Maladies Rares GénoPsy propose un programme de sensibilisation et de formation aux problématiques comportementales de ces maladies rares.
Objectifs :
- Sensibilisation aux problématiques spécifiques du diagnostic des maladies rares à expression psychiatrique
- Sensibilisation à la démarche d’analyse fonctionnelle des comportements défis dans le but de mettre en place des outils d’accompagnement adaptés
- Aux éventuelles répercussions institutionnelles et familiales en lien avec ce type de diagnostic.
- Aux dispositifs ressources disponibles sur le territoire et à la façon de les solliciter
Programme
Jour 1 :
Définitions des maladies rares et enjeux éthiques du diagnostic étiologique
Comportements défis et troubles psychiatriques associés aux maladies rares
Jour 2 :
Enjeux familiaux et institutionnels en lien avec les maladies rares, quelques clés pour mieux appréhender les fonctions cognitives et le handicap cognitif, habiletés sociales & gestion des émotions
Jour 3 :
Autodétermination et médecine personnalisée, dossier MDPH / Protection des biens/ Citoyenneté / Vie affective et sexuelle / Parentalité et génétique
Modalités du contrôle des connaissances
Pré-requis : Aucun
Evaluation : Evaluation des connaissances pré- et post-formation – Retour d’expérience à 6 mois – Questionnaire de satisfaction à l’issue de la formation
Public
Professionnels de première et seconde ligne accompagnant des personnes (enfant ou adulte) présentant une maladie rare à expression psychiatrique
Durée
- 3 jours de 7h (9h-17h) présence obligatoire à tous les temps
- Prochaine session: 06, 07 et 08 février 2023
- Prévoir 1 journée de retour d’expérience à 6 mois en visioconférence
Inscription
Tarif
- 600€ par participant

